В рамках микроскопического подхода структура воды отличается относительно беспорядочным динамически меняющимся расположением молекул, а высокая плотность обуславливает сильное межмолекулярное взаимодействие, осуществляемое посредством водородных связей.
Таким образом, вода представляет собой сложную ассоциированную жидкость с тетраэдрической сеткой молекул, соединенных водородными связями.
В результате теплового движения молекул эта сетка подвержена спонтанной перестройке.
В трехмерной сетке водородных связей размещены флуктуационные микрообъемы молекул воды, обладающие сравнительно малой энергией теплового движения и более высокой степенью структурного упорядочения. Это — микрокластеры.
В то же время вокруг микрокластеров в макрообъеме ассоциированной среды с повышенной энергией теплового движения молекул Н20 наблюдается большая степень структурной беспорядочности, т.е. более низкий уровень структурного упорядочения.
Расскажем об одном курьезе воды.
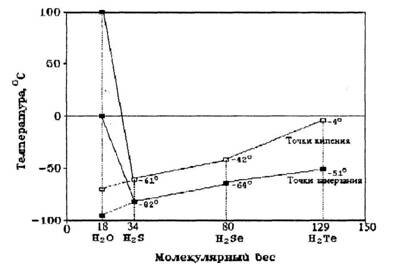
Вещества — аналоги воды, молекулы которых по химическому составу похожи на воду, — H2S, H2Se, H2Te, т.е. соединения водорода и серы, водорода и селена, водорода и теллура и т.д., при комнатной температуре находятся в газообразном состоянии. Казалось бы, вода, сохрани она такие же свойства, должна бы закипать при температуре -70 °С, а превращаться в лед при -90 °С. Эти условия вряд ли бы способствовали развитию жизни на Земле, ведь она должна была бы существовать в интервале температур от -70 °С до -90 °С (рис.3). В таком холоде разве возможна жизнь? Иначе говоря, если бы вода — гидрид кислорода Н2О — была бы нормальным мономолекулярным соединением, таким, например, как ее аналоги по шестой группе Периодической системы элементов Д.И.Менделеева — гидрид серы H2S, гидрид селена H2Se, гидрид теллура H2Te, то в жидком состоянии вода существовала бы в пределах от минус 95 °С до минус 70 °С, а не такая, какая реально существует сейчас. Нетрудно понять, что в этом случае биологической жизни на Земле не могло бы существовать. На рис.3 показаны необычные точки замерзания и кипения воды по сравнению с другими жидкостями.
Рис. 3. Аномалии точек кипения и замерзания воды по сравнению с другими соединениями водорода.
Но, к счастью для нас и для всего живого на свете вода обладает аномальными свойствами.
Вода «не признает» периодических закономерностей, характерных для бесчисленного множества соединений на Земле и в Космосе, а следует своим, еще не вполне понятным для науки законам, подарившим нам удивительный мир Жизни.
«Ненормальные» температуры плавления (0 °С) и кипения (+100 °С) воды далеко не единственная ее аномальность.
Для всей биосферы исключительна важной особенностью воды является ее способность при замерзании увеличивать, а не уменьшать свой объем, т.е. уменьшать плотность.
Действительно, при переходе любой жидкости в твердое состояние молекулы располагаются теснее, а само вещество, уменьшаясь в объеме, становится плотнее. Да, для любой из необозримо разных жидкостей, но не воды. Вода и здесь представляет исключение.
При охлаждении вода сначала ведет себя как и другие жидкости: постепенно уплотняясь, уменьшает свой объем. Такое явление можно наблюдать до +3,98 °С. Затем, при дальнейшем снижении температуры до 0 °С, вся вода замерзает и расширяется в объеме. В результате удельный вес льда становится меньше воды и лед плавает. Если бы лед не всплывал, а тонул, то все водоемы (реки, озера, моря) промерзли бы до дна, испарение бы резко сократилось, все пресноводные животные и растения погибли бы. Жизнь на Земле стала бы невозможной.
Вода — единственная жидкость на Земле, лед которой не тонет за счет того, что его объем на 1/11 больше объема воды.
Еще одно удивительное свойство воды — ее огромное поверхностное натяжение. Благодаря тому, что круглые шарики воды очень упруги, идет дождь, выпадает роса.
Что же это за удивительная сила, которая сохраняет капли росы, а поверхностный слой воды в любой лужице делает эластичным и относительно прочным?
Известно, что если стальную иголку осторожно положить на поверхность воды, налитой в блюдце, то иголка не тонет. А ведь удельная масса металла значительно больше, чем у воды. Молекулы воды связаны силой поверхностного натяжения, которая позволяет им подниматься вверх по капиллярам, преодолевая силу земного притяжения. Без этого свойства воды жизнь на Земле была бы также невозможна.
Ни одно вещества на Земле не обладает такой способностью поглощать тепло, как вода. Для превращения в пар 1г воды требуется 537 калории тепла. Конденсируясь, пар возвращает эти 537 калорий в окружающую среду.
Ни одно вещество в мире не поглощает и не отдает среде столько тепла, сколько вода. Теплоемкость воды в 10 раз больше теплоемкости стали и в 30 раз больше ртути. Вода сохраняет тепло на Земле.
С поверхности морей, океанов, суши испаряется за год 520000 кубических километров воды, которые, конденсируясь, отдают много тепла холодным и полярным регионам.
Не обладай вода такой уникальной способностью поглощать и отдавать тепло, климат Земли оказался бы непригодным для существования человека. В высоких широтах тогда царил бы нестерпимый холод, а в низких — солнце испепелило бы все живое.
Благодаря наземному Мировому океану атмосфера представляет собой надежное теплое одеяло, укрывающее тело планеты и защищающее его от космического холода. Подземный океан снабжает Землю теплом из внутренних источников планеты.