Химический состав воды отвечает на вопрос, из чего состоит молекула воды. А как эта молекула устроена — никто не знал вплоть до августа 1933 года.
Честь окончательного открытия строения молекулы воды, а на ее и структуры воды принадлежит двум английским ученым Дж. Берналу и Р. Фаулеру.
В августовском номере только что созданного международного журнала по химической физике «Journal of Chemical Physics» была опубликована их классическая работа о структуре воды, основанной на взаимодействии молекул воды с себе подобными молекулами и ионами разных сортов.
И что самое интересное, что свое открытие ученые сделали чисто умозрительно.
Правда, в своей научной прозорливости Дж. Бернал и Р. Фаулер опирались на обширный материал накопленных экспериментальных и теоретических данных в области изучения молекул воды, структуры льда, строения простых жидкостей, на данные рентгеноструктурного анализа воды и водных растворов.
Попытки представить воду как ассоциированную жидкость с плотной упаковкой молекул воды, подобно шарикам в какой-либо емкости, не соответствовали элементарным фактическим данным. В этом случае удельная плотность воды (удельный вес) должна была бы быть не 1 г/см3, а более 1,8 г/см3. Это первое. Второе доказательство в пользу особой структуры молекулы воды состояло в том, что в отличие от других жидкостей вода — это было уже известно — обладает сильным электрическим моментом, составляющим ее дипольную структуру.
Поэтому нельзя было представить наличие весьма сильного электрического момента молекулы воды в симметричной конструкции двух атомов водорода относительно атома кислорода, расположив все входящие в нее атомы по прямой линии, т.е. Н-О-Н.
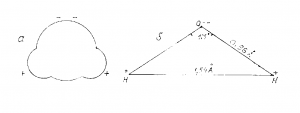
Эти и другие экспериментальные данные, а также математические расчеты окончательно убедили английских ученых в том, что молекула воды «однобока» и имеет «уголковую» конструкцию, а оба атома водорода должны быть смещены в одну сторону относительно атома кислорода (рис.4).
Рис. 4. Форма молекулы воды:
а) электронное облако молекулы воды;
б) взаимное расположение ядер кислорода (О) и водорода (Н) в молекуле Н2O.
Только такая конструкция молекулы воды могла объяснить ажурный способ сцепления молекул друг с другом, структуру воды и необъятный мир ее аномальных свойств.
Дальнейшие многочисленные исследования интернационального мира ученых блестяще подтвердили открытие Дж. Бернала и Р. Фаулера.
В наше время информацию о форме и размерах молекулы воды можно получить, анализируя данные рентгеноструктурного и «машинного» эксперимента, спектра поглощения и других исследований.
Усилиями ученых всего мира, наконец, удалось «увидеть» это удивительное создание — молекулу воды!
На рис.4 показана форма молекулы воды в газообразной фазе и ее основные конструктивные параметры.
Оказалось, что это — шарик с двумя бугорками и с довольно упругой поверхностью, ограниченной электронным облаком. Это облако не однородно. В области «бугорков», где расположены ядра водорода, выявлен недостаток электронной плотности, а в диаметрально противоположной стороне ближе к ядру кислорода — избыток электронной плотности. Указанная структурная особенность предопределяет полярность молекулы воды.
Используя новейшие достижения науки и исследовательской техники, выдающийся датский ученый Н.Бьеррум пришел к выводу о тетраэдрическом взаимном расположении положительных и отрицательных зарядов в молекуле воды. Согласно Н. Бьерруму, если соединить прямыми линиями эпицентры положительных и отрицательных зарядов молекулы воды, то получается правильный тетраэдр, рис. 5.
Не трудно догадаться, что каждая молекула воды в кругу себе подобных должна как-то ориентироваться, притягиваясь разноименными зарядами и отталкиваясь одна от другой одноименными зарядами.